20-01-2026 17:49
 Hardware Tony
Hardware Tony
I offer this collection as a possibility only as e

15-01-2026 15:55
 Lothar Krieglsteiner
Lothar Krieglsteiner
this one is especially interesting for me because

17-01-2026 19:35
Arnold BüschlenHallo, ich suche zu Cosmospora aurantiicola Lite

16-01-2026 00:45
Ethan CrensonHi all, On decorticated hardwood from a New York

18-01-2026 12:24
Hello.An anamorph located on the surface of a thin

08-12-2025 17:37
 Lothar Krieglsteiner
Lothar Krieglsteiner
20.6.25, on branch of Abies infected and thickened
2 questions sur les spores des pezizaceae
Jacques BeckCeccaldi,
13-02-2008 17:46
Ici, sporée récente de Peiza varia.
2- est-i fréquent de voir des germinations à partir des 2 pôles oppoés,de la spore en même temps.
Germinations qui ne semblent pas se produirent uniquement, d'ailleurs, à partir des pôles?
Merci pour la réponse.
Jacques Fournier,
13-02-2008 18:12

Re:2 questions sur les spores des pezizaceae
Bonjour,
c'est un artefact, sur ta photo les spores sont collapsées, ce qui arrive fréquemment dans le lactophénol ou le melzer pour les spores à paroi mince. Très décoratif!
Jacques
c'est un artefact, sur ta photo les spores sont collapsées, ce qui arrive fréquemment dans le lactophénol ou le melzer pour les spores à paroi mince. Très décoratif!
Jacques
François Valade,
13-02-2008 18:17

Re:2 questions sur les spores des pezizaceae
Bonjour
Ce phénomène est fréquent avec les produits cités par Jacques. Dans le bleu, je rechauffe toujours un peu la lame, d'abord les spores reprennent leur volume initial et ensuite le colorant se fixe mieux sur la paroi, ce qui révèle mieux l'ornementation.
Cela arrive aussi avec les spores de myxo dans le Hoyer (présence de lactophénol je crois) et aussi lors de la préparation (métallisation je suppose) des spores pour le microscope électronique à balayage.
François
Ce phénomène est fréquent avec les produits cités par Jacques. Dans le bleu, je rechauffe toujours un peu la lame, d'abord les spores reprennent leur volume initial et ensuite le colorant se fixe mieux sur la paroi, ce qui révèle mieux l'ornementation.
Cela arrive aussi avec les spores de myxo dans le Hoyer (présence de lactophénol je crois) et aussi lors de la préparation (métallisation je suppose) des spores pour le microscope électronique à balayage.
François
Jacques BeckCeccaldi,
13-02-2008 18:25
Re:2 questions sur les spores des pezizaceae
Grand merci pour la réponse de Jacques Fournier, encore que le côté "décoratif" ne soit pas celui qui m"intéresse le plus.
Je préfère l'explication de François Valade qui me permettra, à l'avenir, de penser à réchauffer la préparation. Merci
Je préfère l'explication de François Valade qui me permettra, à l'avenir, de penser à réchauffer la préparation. Merci
René Dougoud,
13-02-2008 20:30
Re:2 questions sur les spores des pezizaceae
Chers Collègues,
Ce phénomène est assez fréquent si l'observe des ascospores dans le bleu cotton, notamment. Il est particulièrement remarquable chez les espèces du genre Tricharina et se retrouve aussi chez beaucoup d'autres espèces, comme chez certains Peziza. Ceci est la conséquence des différentes pression, soit de celle existant dans l'ascospore et celle exercée de l'extérieur sur elle. Les différences résistances des parois sporales font que les ascospores présentent une déformation plus ou moins prononcée en présence d'un liquide donné, tel que le bleu cotton ou autres.
Cordialement
René
Ce phénomène est assez fréquent si l'observe des ascospores dans le bleu cotton, notamment. Il est particulièrement remarquable chez les espèces du genre Tricharina et se retrouve aussi chez beaucoup d'autres espèces, comme chez certains Peziza. Ceci est la conséquence des différentes pression, soit de celle existant dans l'ascospore et celle exercée de l'extérieur sur elle. Les différences résistances des parois sporales font que les ascospores présentent une déformation plus ou moins prononcée en présence d'un liquide donné, tel que le bleu cotton ou autres.
Cordialement
René
Jacques BeckCeccaldi,
13-02-2008 21:24
Re:2 questions sur les spores des pezizaceae
Merci Mr Dougoud pour ces précisons qui changent de "décoratif".
Hans-Otto Baral,
13-02-2008 22:23

Re:2 questions sur les spores des pezizaceae
Hi
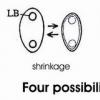
I wish to add that the collapsing of spores is not strictly an artifact but it is a natural response of spores with non-elastic and comparatively thin walls to drying out. You can make a very simple experiment: Either you collect spores of a Pezizales on a slide, or you let a squash mount dry out. After an hour I presume that a spore print is entirely dry (perhaps much earlier). Now you place a dop of oil (immersion oil or any other oil) over the spores or the squash mount and put a cover slip on the oil. Now you can see LIVING but entirely dry spores looking very much the same as those on your photo. (I admit that in oil as mounting medium the contrast is much worse than in lactophenol). I attach here and example of uredospores in which the contrast is very good even in oil.
That means: Spores rapidly dry out when naturally floating in the air after being discharged. Either they collapse or otherwise shrink, or they form DBBs. But they tolerate complete dehydration. Spores are known to show the highest xerotolerance. When you give water to them, they rapidly gain their normal shape (usually within a few seconds).
Zotto
I wish to add that the collapsing of spores is not strictly an artifact but it is a natural response of spores with non-elastic and comparatively thin walls to drying out. You can make a very simple experiment: Either you collect spores of a Pezizales on a slide, or you let a squash mount dry out. After an hour I presume that a spore print is entirely dry (perhaps much earlier). Now you place a dop of oil (immersion oil or any other oil) over the spores or the squash mount and put a cover slip on the oil. Now you can see LIVING but entirely dry spores looking very much the same as those on your photo. (I admit that in oil as mounting medium the contrast is much worse than in lactophenol). I attach here and example of uredospores in which the contrast is very good even in oil.
That means: Spores rapidly dry out when naturally floating in the air after being discharged. Either they collapse or otherwise shrink, or they form DBBs. But they tolerate complete dehydration. Spores are known to show the highest xerotolerance. When you give water to them, they rapidly gain their normal shape (usually within a few seconds).
Zotto
François Valade,
13-02-2008 22:54

Re:2 questions sur les spores des pezizaceae
Zotto
Do you mean that all mounting media (Melzer, lactic blue, Hoyer) have a drying effect on spores, so they collapse. And what about heating the slide versus drying?
François
ps: c'est du chloral pour le Hoyer comme le Melzer d'ailleurs
Do you mean that all mounting media (Melzer, lactic blue, Hoyer) have a drying effect on spores, so they collapse. And what about heating the slide versus drying?
François
ps: c'est du chloral pour le Hoyer comme le Melzer d'ailleurs
Jacques BeckCeccaldi,
14-02-2008 01:36
Re:2 questions sur les spores des pezizaceae
Merci à Hans-Otto Baral pour ces précieuses indications.
J'y répondrai dés demain
J'y répondrai dés demain
Hans-Otto Baral,
14-02-2008 12:57

Re:2 questions sur les spores des pezizaceae
Dear Francois
The "drying effect" of viscous mounting media is because the molecules of the medium (chloral hydrate or whatever) are obviously too large in order to pass the cell wall. So the spore-internal water is extracted into the viscous medium (the system tries to equalize the concentration between outside and inside of the spores). I am not sure whether this collapsing effect is always independent of the living versus dead state of the spores. In the case the dead spores do not collapse or do not form a DBB, whilst the living do, then the molecules are able to pass the spore wall but not the plasmalemma (which is semipermeable only if the spore is alive).
Not in all fungi spores collapse or produce DBBs when adding chloral hydrate. Many simply shrink because the spore wall is elastic and the spore wall permeable for the mounting medium. I have made a table in my vital paper showing the different types of response.
Yes, you may try this: Let spores on a slide dry at room temperature, and on another slide by heating. The spores of both are then collapsed, and the latter most probably dead. You can test this by rehydrating and looking for the cell interior. If you now add Melzer or CB to the water mount, you will get collapsing in the first case (living spores), but I am not sure if you get it in the dead spores.
Zotto
The "drying effect" of viscous mounting media is because the molecules of the medium (chloral hydrate or whatever) are obviously too large in order to pass the cell wall. So the spore-internal water is extracted into the viscous medium (the system tries to equalize the concentration between outside and inside of the spores). I am not sure whether this collapsing effect is always independent of the living versus dead state of the spores. In the case the dead spores do not collapse or do not form a DBB, whilst the living do, then the molecules are able to pass the spore wall but not the plasmalemma (which is semipermeable only if the spore is alive).
Not in all fungi spores collapse or produce DBBs when adding chloral hydrate. Many simply shrink because the spore wall is elastic and the spore wall permeable for the mounting medium. I have made a table in my vital paper showing the different types of response.
Yes, you may try this: Let spores on a slide dry at room temperature, and on another slide by heating. The spores of both are then collapsed, and the latter most probably dead. You can test this by rehydrating and looking for the cell interior. If you now add Melzer or CB to the water mount, you will get collapsing in the first case (living spores), but I am not sure if you get it in the dead spores.
Zotto



 4126.jpg
4126.jpg